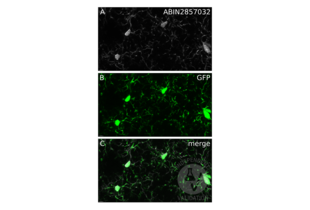
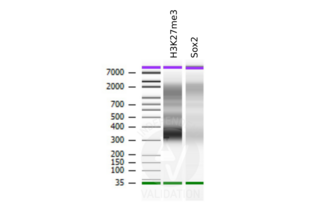
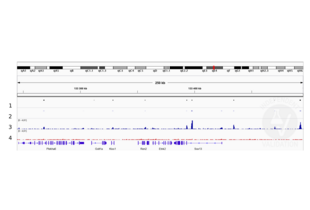
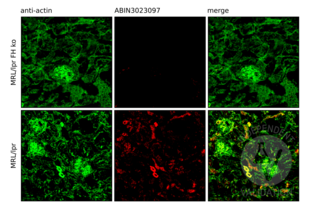
IHC Antikörper
antibodies-online bietet Ihnen derzeit mehr als 250.000 IHC-Antikörper. Wenn Sie Hilfe benötigen, um das richtige Produkt für Ihre Bedürfnisse zu finden, kontaktieren Sie bitte unseren Kundensupport per Telefon, Live-Chat oder E-Mail.
Durchsuchen Sie alle IHC AntibodiesÜberblick über die Immunhistochemie
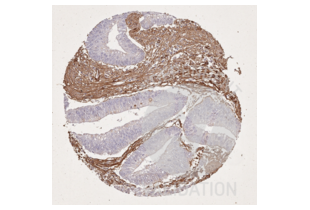
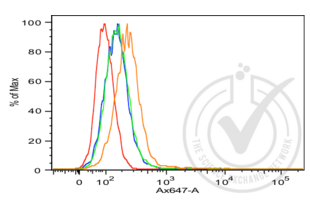
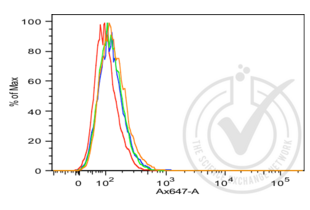
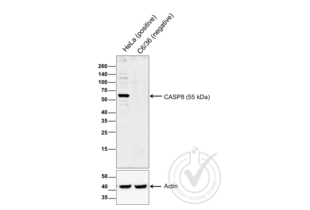
Die Immunhistochemie (IHC) bezeichnet das Verfahren zum Nachweis von Antigenen in Zellen eines Gewebeschnitts unter Ausnutzung des Prinzips der spezifischen Bindung von Antikörpern an Antigene in biologischen Geweben. Es findet breite Anwendung in der Diagnose von abnormen Zellen, wie sie in Krebstumoren vorkommen, und in der Grundlagenforschung, um die Verteilung und Lokalisierung von Biomarkern und unterschiedlich exprimierten Proteinen in verschiedenen Teilen eines biologischen Gewebes zu verstehen. Die Visualisierung einer Antikörper-Antigen-Interaktion kann auf verschiedene Weise erfolgen. In den meisten Fällen wird ein Antikörper mit einem Enzym, wie z. B. Peroxidase, konjugiert, das eine farbgebende Reaktion katalysieren kann, oder mit einem Fluorophor markiert.
Antikörper für IHC
- Über 200.000 Antikörper explizit für Paraffin-einbettete Schnitte getestet
- Über 36.000 Antikörper für gefrorene Gewebeschnitte
- Multiplex IHC Antibodies
Gewebevorbereitung
Die Aufbereitung der Gewebeproben ist von entscheidender Bedeutung, da eine unsachgemäße Behandlung die Gewebestruktur stören, die Bindungsaffinität der Antikörper verringern oder sogar die Bindung ganz verhindern kann. Ziel ist es, das Gewebe unter nahezu naturgetreuen Bedingungen zu konservieren und gleichzeitig Autolyse und Abbau durch Bakterien- oder Pilzwachstum zu verhindern. Zu diesem Zweck werden Fixiermittel wie Paraformaldehyd-Lysin-Periodat (PLP) oder Formalin verwendet. Das gebräuchlichste Fixiermittel ist 4%-10% (in manchen Fällen bis zu 40%) Formaldehyd in 0,1M Phosphatpuffer (um den pH-Wert zu stabilisieren).
Für Gewebe, das keine Formaldehyd-Inkubation verträgt, besteht eine häufig verwendete Alternative darin, dass die Proben in flüssigem Stickstoff eingefroren und dann in Schnitte geschnitten werden. Mit Fixiermitteln bebrütete Gewebe werden in eine Matrix, z. B. Paraffin, oder, nachdem sie dehydriert wurden, in Alkohol (Isopropanol oder Ethanol) eingebettet und anschließend in Schnitte geschnitten. Bei empfindlichen Geweben kann die Verwendung eines Vibratom-Mikrotoms ratsam sein, da es eine geringere physische Belastung für das Gewebe darstellt.
Antigen-Gewinnung
Trotz der besseren Konservierungsqualität in Bezug auf die Morphologie können formalinfixierte, in Paraffin eingebettete Proben aufgrund von strukturellen Veränderungen des Zielantigens einige oder alle Immunreaktivitäten verlieren. Der Nachweis von Antigenen und damit die Immunreaktivität kann durch verschiedene Techniken verbessert werden. Im Wesentlichen gibt es zwei verschiedene Ansätze, nämlich die Wärmebehandlung, das so genannte "heat induced epitope retrieval" (HIER), und das "proteolytic induced epitope retrieval" (PIER). Um diese Techniken anwenden zu können, müssen die Gewebeschnitte zunächst entparaffiniert und rehydriert werden.
HIER funktioniert durch die Anwendung einer so genannten Retrieval-Lösung. Dieser vorgewärmte Puffer hat eine unterschiedliche Zusammensetzung und einen unterschiedlichen pH-Wert und besteht häufig aus Tris-HCl oder Citrat. Die entnommenen Proben werden unterschiedlich lange erhitzt (in der Regel zwischen 10 und 60 Minuten) und dann langsam abgekühlt. Das Erhitzen selbst kann mit Hilfe eines Autoklaven, Wasserbads, Druckkochers oder eines ähnlichen Geräts erfolgen.
PIER funktioniert durch den Einsatz von Verdauungsenzymen, wie Proteinase K, Trypsin, Pepsin und verschiedenen anderen Proteinasen. Optimale Inkubationszeiten und Konzentrationen müssen getestet werden. Im letzten Durchlauf sollten die Probenspezifitäten optimiert werden. Gelegentlich kann es erforderlich sein, HIER und PIER zu kombinieren, um nach der Formalin-Inkubation eine Antigen-"Demaskierung" zu erreichen.
Methoden zur Erhaltung
Direkte Methode
Bei dieser Methode reagiert ein markierter Antikörper (z.B. mit einem Substrat-Chromogen) direkt mit dem Antigen im Gewebe. Der Vorteil ist, dass nur ein Antikörper benötigt wird, die Anwendung daher schnell ist und wenig unspezifische Bindungen erzeugt. Da jedoch nur ein Antikörper an ein Epitop bindet, ist die Signalintensität gering. Für Anwendungen mit geringen Antigenmengen kann das Signal zu schwach sein.
Indirekte Methode (zweistufig)
Um die geringe Signalintensität der direkten Methode aufzuwerten, wurde die indirekte Methode entwickelt. Der primäre Antikörper bindet an das Antigen, gefolgt von einem zweiten (markierten) Antikörper, der den primären bindet. Das Signal wird durch die Bindung mehrerer sekundärer Antikörper an einen einzigen primären Antikörper verstärkt. Ein weiterer Vorteil ist, dass nur ein markierter Antikörper für verschiedene Ziele verwendet werden muss, was die Kosten senken kann. Ein Nachteil ist, dass unspezifische Bindungen häufiger auftreten als bei der direkten Methode.
Dreistufige Methode
Um das Signal weiter zu verstärken, kann ein zusätzlicher Antikörper eingesetzt werden, der an den sekundären Antikörper bindet. Diese Methode führt zu einer dritten Schicht von Antikörpern, die alle markiert sind. Diese Anwendung ist nützlich für die Färbung von Antigenen mit einer begrenzten Anzahl von Epitopen.
PAP-Methode
Die Peroxidase-Anti-Peroxidase-Methode wird heute nur noch selten verwendet, war aber früher in Pathologielabors sehr beliebt. Es handelt sich um eine indirekte Methode, bei der eine dritte Schicht von Antikörpern, die an Peroxidase gebunden sind, einen nicht konjugierten Antikörper der zweiten Schicht bindet. Die Peroxidase ist nicht chemisch mit dem IgG konjugiert, sondern immunologisch gebunden. Das bedeutet, dass der Drittschicht-Antikörper spezifisch für Peroxidase ist. Dies führt zu einer viel höheren Aktivität der Peroxidase, was wiederum die Empfindlichkeit des Assays um zwei bis drei Größenordnungen erhöht.
(Strept) Avidin-Biotin-Komplex (ABC) Methoden
Eine der heute am häufigsten verwendeten Färbemethoden basiert auf der hohen Affinität von Avidin (Hühnerei) und Streptavidin (Streptomyces avidinii) zu dem Glykoprotein Biotin. Das Grundprinzip besteht darin, dass Avidin (oder Streptavidin) mit einem biotinylierten Sekundärantikörper reagiert, gefolgt von einer Meerrettichperoxidase-Reaktion.
In einigen Fällen wird die katalysierte Signalverstärkung (CSA) eingesetzt. Ein Verstärkungsreagenz führt zur Aggregation einer großen Anzahl von Biotinen, die anschließend mit Streptavidin-markierter Peroxidase reagieren. Ein Problem mit Avidin ist die starke elektrostatische Bindung, die auf seine molekulare Ladung zurückzuführen ist. Streptavidin hat nicht die gleiche Neigung, wodurch das Hintergrundsignal verringert wird.
Polymere Methoden
Kurz gesagt, werden bei polymeren Methoden große, an Antikörper gebundene Polymere eingesetzt, die eine größere Anzahl von Molekülen binden können, in der Regel durchschnittlich zehn Antikörper und etwa 70 Enzymmoleküle. Dieser Aufbau ermöglicht eine hervorragende Verstärkung des Signals und damit eine hohe Empfindlichkeit, eine geringere unspezifische Bindung und damit ein niedriges Hintergrundsignal. Außerdem können damit zwei verschiedene Antigene gleichzeitig angefärbt werden.
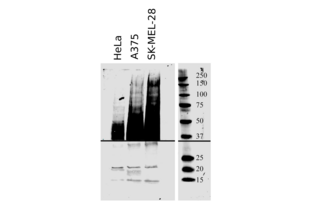
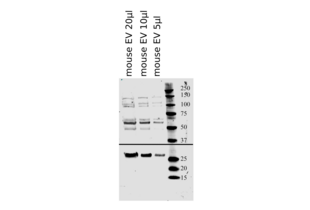
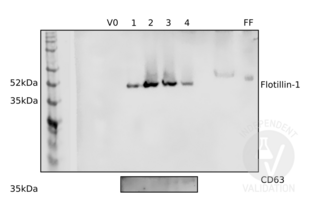
IHC Antibodies
Ergebnisse filtern:
Möchten Sie unsere AI Suche ausprobieren?
229.086 Treffer
 356 Referenzen
356 Referenzen
 1 Validierung
1 Validierung
 272 Referenzen
272 Referenzen
 62 Referenzen
62 Referenzen
 2 validations
2 validations
 14 Referenzen
14 Referenzen
 1 Validierung
1 Validierung
 15 Referenzen
15 Referenzen
 1 Validierung
1 Validierung
 21 Referenzen
21 Referenzen
 1 Validierung
1 Validierung
 10 Referenzen
10 Referenzen
 3 validations
3 validations
 13 Referenzen
13 Referenzen
 1 Validierung
1 Validierung
 11 Referenzen
11 Referenzen
 1 Validierung
1 Validierung
 122 Referenzen
122 Referenzen
 105 Referenzen
105 Referenzen
 1 reference
1 reference
 1 Validierung
1 Validierung
 2 Referenzen
2 Referenzen
 1 Validierung
1 Validierung
 1 reference
1 reference
 1 Validierung
1 Validierung
 2 Referenzen
2 Referenzen
 1 Validierung
1 Validierung