Western Blot: Gelelektrophorese für Proteine
Martin HolschbachWas ist Western Blotting?
Der Western Blot stellt ein Verfahren zum Nachweis von Proteinen in einem Proteingemisch (z.B. Zelllysat) dar. Im ersten Schritt wird das Proteingemisch mittels einer Gel-Elektrophorese in einer Trägermatrix (SDS-PAGE, Native-PAGE, isoelektrische Fokussierung, 2D-Gelelektrophorese, usw.) entsprechend der Protein-Größe, -Ladung oder anderer Eigenschaften aufgetrennt in einzelne Proteinbanden. Die getrennten Proteinbanden werden danach für den Western Blot aus dem Gel auf eine feste Trägermembran (z.B. aus Nitrozellulose, Nylon oder PVDF) transferiert. Dieser Vorgang wird Blotting genannt. Aufgrund Ladungswechselwirkungen bleiben die Proteine an der Membranoberfläche im Muster der elektrophoretischen Auftrennung haften und sind für die Antikörper-Bindung zur Detektion zugänglich.
entstand als Namensspiel, in Anlehnung an den sogenannten Southern Blot, einem ähnlichen Verfahren zum Nachweis spezifischer DNA-Sequenzen. Der Southern Blot wurde durch Ed Southern erstmals beschrieben und nach ihm benannt. Ein weiteres Wortspiel ist der Northern Blot und Southwestern Blot.
Gelelektrophorese
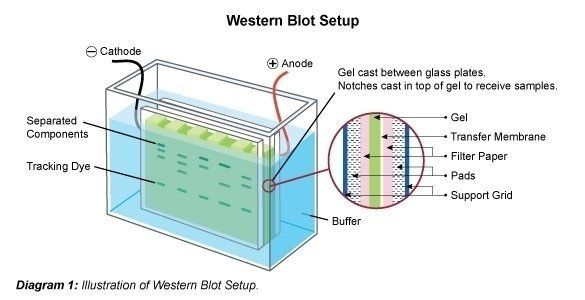
Zur Auftrennung der Proteine kann man zwischen verschiedenen Elektrophorese-Arten wählen, je nachdem nach welchen Kriterien die Proteine getrennt werden sollen. Als Methoden bieten sich insbesondere SDS-PAGE, Nativ-PAGE und die isoelektrische Fokussierung an.
SDS-PAGE
Es handelt sich hierbei um ein denaturierendes Verfahren. Die Denaturierung kommt durch die Behandlung der Proteine mit dem anionischen Detergens SDS (Natriumdodecylsulfat) zustande. Bei der Behandlung mit SDS gehen die Sekundär- und Tertiärstrukturen der Proteine verloren. Darüber hinaus lagert sich das SDS an die Proteine an und verdeckt deren Eigenladung. Das Protein ist danach gleichmäßig negativ geladen. Die anschließende Trennung erfolgt anhand der relativen Größe der Polypeptidketten im Polyacrylamidgel.
Empfohlene SDS-PAGE Puffer und Kits
Nativ-PAGE
Dies ist eine Variante der Gelelektrophorese, bei der native, gefaltete, nicht-denaturierte Proteine aufgetrennt werden. Mit dieser Methode ist es möglich, Proteine aufzuspalten, die mit anderen Methoden nicht zu trennen sind. Dazu gehören zum Beispiel modifizierte und nicht-modifizierte Proteine derselben Art (z.B. Trennung eines Proteins in seiner phosphorylierten und nicht-phosphorylierten Form). Ebenso dient es dazu, Proteine zu trennen, die biologisch relevante Konformationen aufweisen und z.B. in di-, tri- oder tetramerer Form vorkommen (im Gegensatz zur SDS-PAGE, bei der die denaturierten Polypeptidketten einzeln aufgetrennt werden). Es ist ebenfalls möglich, Komplexe aus verschiedenen Proteinen nachzuweisen.
Die Trennung mit dem Nativ-PAGE ist von verschiedenen Parametern abhängig. Dazu gehört die Ladung des Proteins, seine Größe und seine räumliche Struktur. Um die Faltung der Proteine während des Verfahrens beizubehalten, muss ein geeigneter Puffer verwendet werden. Die Eignung des Puffers hängt vom isoelektrischen Punkt bzw. den Ladungseigenschaften des Proteins ab.
Isoelektrische Fokussierung
Bei dieser Methode macht man sich zu Nutze, dass jedes Protein eine bestimmte Ladung bei einem bestimmten pH-Wert besitzt. Je nach pH-Wert tragen die sauren und basischen funktionellen Gruppen eines Proteins mehr oder weniger stark zu seiner Gesamtladung bei. Der pH-Wert, bei dem genauso viele positive wie negative Ladungen innerhalb des Proteins vorliegen und beim dem die Gesamtladung null ist, bezeichnet man als Isoelektrischen Punkt.
Für die isoelektrische Fokussierung benötigt man spezielle Gele, die einen pH-Gradienten aufweisen, d.h. der pH-Wert innerhalb des Gels ändert sich z.B. von sauer zu basisch. Legt man an ein solches Gel eine elektrische Spannung an, so wandert ein Protein bis zu der Stelle im Gel, an der der pH-Wert dem isoelektrischen Punkt des Proteins entspricht und seine Gesamtladung null ist. Das Verfahren dient zur ladungsabhängigen Trennung von Proteingemischen sowie zur Ermittlung des isoelektrischen Punktes eines Proteins. Die Trennung erfolgt nach Ladung des Proteins, bzw. anhand der Anzahl saurer oder basischer funktioneller Gruppen, die das Protein enthält.
Neben den oben genannten Methoden können auch andere, z.B. kombinierte, Methoden zur Proteintrennung eingesetzt werden. Die Methode der Wahl hängt von den speziellen Anforderungen des Experiments ab.
Blotting
Nach der Trennung des Proteingemischs erfolgt das Aufbringen der Polypeptidbanden auf einen festen Träger, die Membran. Dazu wird das Gel mit den Polypeptidbanden in eine spezielle Elektrophoresekammer gegeben, in der sich auch die Membran befindet. An dieser Stelle ist es möglich, eventuell vorhandenes SDS auszuwaschen, so dass die Proteine teilweise renaturieren und ihre Sekundär- und Tertiärstruktur partiell wiedererlangen. Durch das Anlegen einer elektrischen Spannung senkrecht zur Laufrichtung des Gels wandern die Proteinbanden aus dem Gel heraus und gelangen auf die Membran, wo sie gebunden werden. Das Muster der getrennten Proteinbanden bleibt dabei erhalten. Die „geblotteten“ Banden sind nun weiteren Methoden zugänglich (z.B. für die Detektion bestimmter Proteine mit spezifischen Antikörpern).
Immunodetektion
Nach Trennung und Blotting der Proteinbanden ist es möglich, bestimmte Proteine mit spezifischen Antikörpern zu identifizieren. Der spezifische Antikörper (mono- oder polyklonal) bindet an seiner Proteinbande. Unspezifisch bindende Antikörper können mittels Waschen entfernt werden (mit Pufferlösungen, die Detergenzien enthalten). Außerdem ist es möglich, vor der Antikörperzugabe unspezifische Bindungsstellen zu blockieren.
Empfohlene Blocking Puffers & Lysis Buffers für Western Blotting
In der Regel wird zuerst ein primärer Antikörper eingesetzt, der wiederum durch einen Sekundärantikörper nachgewiesen wird. Bei dem Sekundärantikörper handelt es sich um ein Konjugat, in dem der Antikörper mit einem Farbstoff, einem Enzym oder radioaktiv markiert ist. Es werden auch oft Biotin-konjugierte Antikörper verwendet.
Es kann von Vorteil sein, als Primärantikörper polyklonale Antikörper einzusetzen. Monoklonale Antikörper haben in der Regel eine niedrigere Bindungsaffinität als polyklonale Antikörper. Bei polyklonalen Antikörpern hat man dagegen mehrere Epitope zur Auswahl, die erkannt werden können. Nach der Immundetektion ist es möglich, den gebundenen Antikörper wieder zu entfernen (stripping) und die Membran für weitere Analysen mit anderen Antikörpern einzusetzen (etwa um andere Proteine aus einem Gemisch nachzuweisen).
Die Auswertung des Western Blots erfolgt über verschiedene Imaging Systeme (Lumineszenz, Farbreaktion, Autoradiographie, usw.).
Note: Die Identifizierung eines Proteins in einem Western Blot hängt unter anderem von seinem Molekulargewicht ab. Zu diesem Zweck werden die elektrophoretisch getrennten Proteine in der Probe mit einem Molekulargewichtsstandard einer bekannten Zusammensetzung verglichen.
Warum Western Blot?
Die Western Blot Methode besitzt einige Vorteile gegenüber anderen ISAs (immunosorbent assays), wie etwa dem ELISA. Die Methode ist um einen Aspekt erweitert: der Auftrennung des Proteingemisches nach Größe, Ladung und/oder Konformation. Während ein ELISA nur die Detektion und Quantifizierung eines bestimmten Proteins/Peptids erlaubt, kann man die geblotteten Proteinbanden auf unterschiedliche relevante Proteinen analysieren, indem man verschiedene Antikörper einsetzt und wieder entfernt (strippen). Zudem erhält man über die Trennung der Proteinbanden eine zusätzliche Information über die Größe des detektierten Proteins/Polypeptids. Darüber hinaus ist auch eine (Semi-)Quantifizierung möglich, wenn man einen internen Mengenstandard mit überprüft. Auch der Proteingehalt der verschiedenen Proben lässt sich untereinander vergleichen (Probe A enthält mehr Protein als Probe B).
Ein Nachteil des Western Blots ist, dass er zeitaufwendiger als ein ELISA ist und Erfahrung des Experimentators erfordert. Ebenso ist eine Optimierung der Versuchsbedingungen erforderlich (z.B. bei der Art der Proteinisolation, bei den Puffersystemen, dem Trennverfahren, der Gelkonzentration, usw.).
Die Anwendungsmöglichkeiten des Western Blots sind sehr vielfältig, so dass diese Methode für die verschiedensten Themengebiete angewandt wird.
Beliebte Antikörper für Westernblotting
Ressourcen
Isotypkontrollen für Western Blotting
TrueBlot® Antibodies, Kits, Tools
Westernblotting in Kürze - Die wichtigsten FAQ
Was ist Western Blotting?
Western Blotting ist eine Labormethode zum Nachweis und zur Charakterisierung von Proteinen in einer Probe. Western Blotting, auch bekannt als Immunoblotting, ist eine weit verbreitete Labortechnik in der Molekularbiologie und Biochemie. Sie dient dem Nachweis spezifischer Proteine in einer komplexen Mischung von Proteinen, die aus Zellen oder Geweben extrahiert wurden. Das Verfahren umfasst eine Reihe von Schritten, die mit der Auftrennung der Proteine auf der Grundlage ihrer Größe mittels Gelelektrophorese beginnen. Die Proteine werden dann auf eine Membran übertragen und anschließend mit spezifischen Antikörpern, die an das gewünschte Zielprotein binden, untersucht. Durch eine Reihe chemischer Reaktionen werden die gebundenen Antikörper sichtbar gemacht, was die Identifizierung und Quantifizierung des Proteins ermöglicht. Western Blotting liefert wertvolle Informationen über die Proteinexpression, posttranslationale Modifikationen und Protein-Protein-Interaktionen und ist damit ein unverzichtbares Instrument in der biologischen Forschung und der klinischen Diagnostik.
Wofür wird Western Blotting eingesetzt?
Western Blotting dient der Identifizierung von Proteinen von Interesse in komplexen Proteinmischungen. Es wird häufig in der Molekularbiologie eingesetzt, um die Proteinexpression zu bestimmen und die Zielproteine in biologischen Proben nachzuweisen.
Wie funktioniert das Western-Blotting-Verfahren?
Bei einem Western Blot werden die Proteine zunächst durch Gelelektrophorese nach ihrer Größe getrennt und dann auf eine Nitrocellulose- oder PVDF-Membran übertragen. Die Membran wird dann mit einem primären Antikörper inkubiert, der spezifisch an das Zielprotein von Interesse bindet. Nach dem Abwaschen aller nicht gebundenen primären Antikörper wird die Membran mit einem sekundären Antikörper inkubiert, der den primären Antikörper erkennt und an ihn bindet. Der sekundäre Antikörper ist in der Regel mit einem Detektionsmolekül konjugiert, z. B. einem Enzym oder einer fluoreszierenden Markierung, die ein Signal erzeugt, das sichtbar gemacht werden kann.
Was ist der Unterschied zwischen einem reduzierenden und einem nativen Western
Blot? Bei einem reduzierenden oder denaturierenden Western Blot werden die Proteine analysiert, nachdem sie denaturiert und reduziert wurden, um ihre Disulfidbindungen aufzubrechen. Das Ergebnis ist eine Proteinprobe, die sich nicht mehr in ihrem nativen Zustand befindet, sondern den Nachweis einzelner Untereinheiten oder Monomere ermöglicht. Der Elektrophoresepuffer enthält in der Regel SDS, um die denaturierten Proteine gleichmäßig zu beschichten und sie linearisiert zu halten, so dass sie nach ihrem Molekulargewicht getrennt werden. Ein nativer Western Blot wird verwendet, um Proteine in ihrem nativen Zustand zu analysieren, ohne ihre Struktur oder Wechselwirkungen zu stören. Er wird in der Regel unter nicht reduzierenden Bedingungen durchgeführt, was bedeutet, dass die Disulfidbindungen zwischen Cysteinresten nicht reduziert werden. Ihre Struktur und möglicherweise Wechselwirkungen mit anderen Proteinen bleiben intakt und beeinflussen die Migration während der Elektrophorese. Reduzierende Western Blots werden in der Regel zum Nachweis eines bestimmten Proteins oder einer Untereinheit eines Proteinkomplexes verwendet. Native Western Blots werden verwendet, um intakte Proteine oder Protein-Protein-Wechselwirkungen zu analysieren.
Welche Materialien und Reagenzien werden für einen Western Blot benötigt?
Für einen Western Blot benötigt man eine Proteinprobe, ein Polyacrylamid-Gel, eine Nitrocellulose- oder PVDF-Transfermembran, Transfer- und Blocking-Puffer, einen primären und einen sekundären Antikörper, Nachweisreagenzien wie ECL-Substrat und Geräte für die Gelelektrophorese und den Membrantransfer. Zusätzliche Reagenzien wie Reduktionsmittel, Ladepuffer und Molekulargewichtsmarker können je nach Experiment ebenfalls erforderlich sein.
Wie bereiten Sie die Proben für den Western Blot vor?
Für einen reduzierenden Western Blot werden die Proben in einem Laemmli-Puffer aufgelöst und dann gekocht, um sicherzustellen, dass alle Proteine in der Probe denaturiert sind. Die Mischung wird dann vor dem Beladen schnell auf Eis abgekühlt, damit die Proteine in ihrer denaturierten, linearen Form bleiben. Zur Vorbereitung der Proben für einen nativen Western Blot wird die Probe in der Regel mit einem nativen Probenpuffer gemischt, der ein nichtionisches Detergens wie Triton X-100 enthält, um die Proteine zu lösen, ohne ihre native Struktur oder Wechselwirkungen zu stören. Coomassie-Blau kann beim nativen Western Blotting verwendet werden, um die Proteine während der Elektrophorese zu binden und zu beschichten (blau-native PAGE).
Welche Art von Gel sollte für den Western Blot verwendet werden?
Polyacrylamidgel ist das am häufigsten verwendete Gel für Western Blotting. Die denaturierende SDS-PAGE wird in der Regel für die Trennung von Proteinen auf der Grundlage ihres Molekulargewichts verwendet. Bei der SDS-PAGE wird ein diskontinuierliches Puffersystem mit zwei Gelen verwendet - ein Stapelgel und ein Auflösungsgel. Das Stapelgel hat einen geringen Acrylamidanteil und dient der Konzentration und Fokussierung der Proteinprobe in einem schmalen Band, während das Auflösungsgel einen höheren Acrylamidanteil hat und die Proteine anhand ihrer Größe trennt. Beim reduzierenden Western Blotting wird dem Probenpuffer häufig ein Reduktionsmittel wie Beta-Mercaptoethanol oder Dithiothreitol (DTT) zugesetzt, um die Disulfidbindungen zwischen Cysteinresten aufzubrechen und die Proteine vollständig zu denaturieren. Beim nativen Western Blotting wird das Gel unter nicht denaturierenden Bedingungen hergestellt, und die Disulfidbindungen werden nicht reduziert. Dies geschieht in der Regel mit einem "nativen" Gelsystem oder einem "blau-nativen" Gelsystem (BN-PAGE), bei dem ein nichtionisches Detergens wie Triton X-100 verwendet wird, um die native Konformation der Proteine zu erhalten.
Wie werden die Proteine auf die Membran übertragen?
Am häufigsten werden die Proteine durch Elektroblotting vom Polyacrylamidgel auf eine Blotting-Membran übertragen. Bei einem Tank Blot (Nasstransfer) wird das Gel zwischen zwei mit Transferpuffer getränkte Pads oder Schwämme gelegt, und eine Membran wie Nitrocellulose oder PVDF wird auf das Gel gelegt. Der Stapel wird dann in eine Elektrophoresekammer gelegt, und es wird ein Strom angelegt, um die Proteine vom Gel auf die Membran zu übertragen. Der Transferpuffer enthält in der Regel ein Puffersystem, das einen pH-Wert und eine Ionenstärke aufrechterhält, die den Proteintransfer unterstützen, sowie Methanol oder Ethanol zur Steigerung der Transfereffizienz. Bei einem "halbtrockenen Transfer" umgeben mit Transferpuffer getränkte Filterpapierpads das Gel und die Membran. Das Sandwich wird in direkten Kontakt mit zwei Elektroden gebracht, über die ein elektrisches Feld angelegt wird. Nach dem Transfer wird die Membran blockiert, um eine unspezifische Bindung von Nachweisantikörpern zu verhindern, und dann mit primären und sekundären Antikörpern inkubiert, die für das betreffende Protein spezifisch sind. Die gebundenen Antikörper werden dann durch Chemilumineszenz oder andere Nachweismethoden nachgewiesen, und das Signal wird mit einem Röntgenfilm oder einem digitalen Bildgebungssystem erfasst.
Wie kann die unspezifische Bindung im Western Blot reduziert werden? Wie erfolgt die Membranblockierung und warum ist sie wichtig?
Nach dem Transfer der Proteine vom Elektrophoresegel auf die Blotting-Membran wird die Membran mit einem Blotting-Puffer inkubiert, der Proteine wie BSA oder Milchpulver enthält. Diese Proteine beschichten die Membran homogen und blockieren die unspezifische Bindung der Nachweisantikörper. Durch die Blockierung der Membran wird die unspezifische Bindung verhindert und das Hintergrundsignal reduziert.
Welche Antikörper werden beim Western Blotting verwendet?
Zur Bindung an das Protein wird ein primärer Antikörper verwendet, der für das betreffende Protein spezifisch ist, oder alternativ ein Protein-Tag. Ein sekundärer Antikörper, der an den primären Antikörper bindet, wird in der Regel zum Nachweis verwendet. Häufig ist der sekundäre Antikörper mit einem Enzym wie Meerrettichperoxidase (HRP) konjugiert, das ein Substrat wie ECL umwandelt, um die mit dem Antikörper markierte Proteinbande auf der Blotting-Membran nachzuweisen. Primäre Antikörper erkennen spezifische Proteine, während sekundäre Antikörper an die primären Antikörper binden und ein nachweisbares Signal erzeugen. Ein markierter sekundärer Antikörper kann zusammen mit primären Antikörpern gegen verschiedene Proteine von Interesse verwendet werden, um das Signal zu verstärken. Es ist auch möglich, den primären Antikörper direkt zu markieren, um eine zweite Inkubation und die damit verbundenen Waschschritte zu vermeiden.
Wie werden Proteinbanden auf der Membran nachgewiesen?
Proteinbanden werden durch die Verwendung von Nachweisreagenzien, wie z. B. chemilumineszierende Substrate, die durch ein Enzym wie HRP umgewandelt werden, sichtbar gemacht. Das erzeugte Chemilumineszenzsignal kann dann mit einem Film oder einem digitalen Bildgebungssystem aufgenommen werden.
Wie wird die Menge des Proteins im Western Blot quantifiziert?
Die Quantifizierung von Proteinen mittels Western Blot ist semi-quantitativ. Aufgrund seiner oberen und unteren Nachweisgrenze ist der Western Blot in erster Linie eine qualitative Methode. Die Proteinmenge kann beim Western Blot durch Messung der Intensität des Proteinsignals auf der Membran mittels Densitometrie geschätzt werden. Dazu wird ein spezielles Gerät wie ein Scanner oder ein Bildgebungssystem verwendet, um die Signalintensität der Proteinbanden auf der Membran zu erfassen, in der Regel als digitales Bild. Das Bild kann dann mit einer Software analysiert werden, die die Signalintensität jeder Bande misst, und dieser Wert kann mit einer Standardkurve oder Kontrollprobe verglichen werden, um die Proteinmenge zu quantifizieren. Alternativ dazu verwenden einige Western-Blotting-Systeme eine vorgefärbte Molekulargewichtsleiter oder ein Referenzprotein in der Probe als interne Kontrolle, um die Proteinmenge anhand ihrer relativen Intensität im Vergleich zur Kontrolle zu schätzen.
Wie kann eine spezifische Bindung im Western Blot nachgewiesen werden? Wie wird die Qualität und Reproduzierbarkeit von Western-Blot-Daten sichergestellt?
Die spezifische Bindung kann durch den Vergleich von Positiv- und Negativkontrollen, verschiedenen primären Antikörpern gegen dasselbe Protein von Interesse und orthogonalen Methoden wie Chromatographie, Massenspektrometrie oder Durchflusszytometrie bestätigt werden. Reproduzierbare Ergebnisse bei biologischen und technischen Wiederholungen sichern die Qualität der Daten.
Was sind die Vorteile des Western Blotting im Vergleich zu anderen Proteinanalysemethoden?
Western Blotting ermöglicht die hochspezifische Identifizierung von Proteinen, die semiquantitative Analyse, die Untersuchung mehrerer Proteine in einer Probe und - je nach Versuchsaufbau - den Nachweis von Proteininteraktionen. Im Vergleich zu anderen auf Proteine fokussierten Methoden wie Chromatographie, Durchflusszytometrie oder Massenspektrometrie ist der Western Blot kostengünstig, leicht zugänglich und schnell.
Was sind typische Probleme und Herausforderungen beim Western Blotting und wie lassen sie sich lösen?
Zu den typischen Problemen beim Western Blotting gehören unspezifische Bindungen und Hintergrundsignale, schwache Signale und Schwierigkeiten beim Nachweis gering exprimierter Proteine sowie Schwankungen zwischen den Experimenten. Diese Probleme können durch die Optimierung von Antikörpern, Blockierungsmethoden und Protokollparametern sowie durch die Verwendung interner Kontrollen behoben werden.
Gibt es alternative Methoden zum Western Blotting?
Ja, es gibt alternative Proteinanalysemethoden wie ELISA, Massenspektrometrie, Protein-Arrays, Durchflusszytometrie und immunhistochemische Techniken, die je nach Anwendungsbereich eingesetzt werden können.
Was sind die Hauptanwendungen des Western Blotting in der Forschung oder der klinischen Diagnostik?
Western Blotting ist eine vielseitige Technik, die den Nachweis eines bestimmten Proteins in einer Probe ermöglicht. Daher kann es für eine Vielzahl von Anwendungen in Forschung und Klinik eingesetzt werden, was es zu einem unverzichtbaren Instrument für viele Wissenschaftler und Kliniker macht. Einige der wichtigsten Anwendungen des Western Blotting sind die Krankheitsdiagnose durch den Nachweis spezifischer Marker, die Antikörpervalidierung für nachgelagerte Anwendungen wie Immunhistochemie oder Durchflusszytometrie, der Nachweis von Antikörpern in Serumproben zur Beurteilung der Wirksamkeit von Impfstoffen oder die Qualitätskontrolle bei der Herstellung von Biosimilars zur Gewährleistung der Konsistenz.




