Fab Fragment Antikörper
Kategorien
Fab-Fragment-Antikörper (Fab = fragment antigen-binding region) sind ein wertvolles Instrument in der molekularbiologischen Forschung und Diagnostik. Diese Antikörper werden durch den Prozess des Papain-Verdaus erzeugt, der das Antikörpermolekül spaltet und Fab-Fragmente erzeugt. Die Fab-Fragmente mit einem Molekulargewicht von etwa 50 kDa behalten die Antigen-bindenden Regionen des ursprünglichen Antikörpers, während der Fc-Teil (Fc = fragmentierte kristallisierbare Region) fehlt.
Entdecken Sie unser Angebot an Fab-Antikörpern
Durch das Entfernen des Fc-Teils eliminieren Fab-Fragment-Antikörper das Potenzial für Interaktionen mit Fc-Rezeptoren auf Zellen oder in vitro Fc-Bindungsmechanismen. Aufgrund dieser Eigenschaft eignen sich Fab-Fragmente besonders für Studien, die eine präzise Ausrichtung auf spezifische Antigene ohne Beeinträchtigung durch Fc-vermittelte Prozesse erfordern.
Eine der Hauptanwendungen von Fab-Fragment-Antikörpern sind Experimente, bei denen zwei primäre Antikörper der gleichen Wirtsspezies verwendet werden, z. B. zwei monoklonale Maus-Antikörper des IgG-Isotyps. In solchen Fällen wird zunächst ein konjugiertes Fab-Fragment-Anti-Maus-IgG eingesetzt. Dieser Fab-Fragment-Antikörper bindet spezifisch an die Oberfläche des Maus-IgG-Antikörpers und blockiert somit alle verfügbaren Bindungsstellen für Anti-Maus-IgG-Antikörper.
Die monovalente Natur der Fab-Fragment-Antikörper verhindert, dass sie an weitere Maus-IgG-Antikörper binden, selbst wenn sie erneut in das System eingebracht werden. Diese Eigenschaft ist für die nachfolgenden Schritte des Experiments entscheidend. Nach der Applikation des konjugierten Fab-Fragment-Antikörpers wird ein zweiter primärer Antikörper (ebenfalls ein Maus-IgG) appliziert, der auf ein anderes Antigen von Interesse abzielt. Um das Vorhandensein des zweiten primären Antikörpers nachzuweisen, wird ein zweites konjugiertes Anti-Maus-IgG verwendet.
Fab-Fragment-Antikörper bieten zahlreiche Vorteile in Versuchsumgebungen, in denen mehrere primäre Antikörper von derselben Wirtsspezies verwendet werden. Ihre monovalente Natur in Verbindung mit der Fähigkeit, Bindungsstellen zu blockieren, bietet die Möglichkeit, Herausforderungen beim Nachweis und der Differenzierung von Zielantigenen zu überwinden. Dank ihrer optimierten Permeabilität sind Fab-Fragment-Antikörper zu unverzichtbaren Werkzeugen in verschiedenen Forschungsanwendungen geworden, darunter Immunhistochemie, Immunfluoreszenz und Durchflusszytometrie.
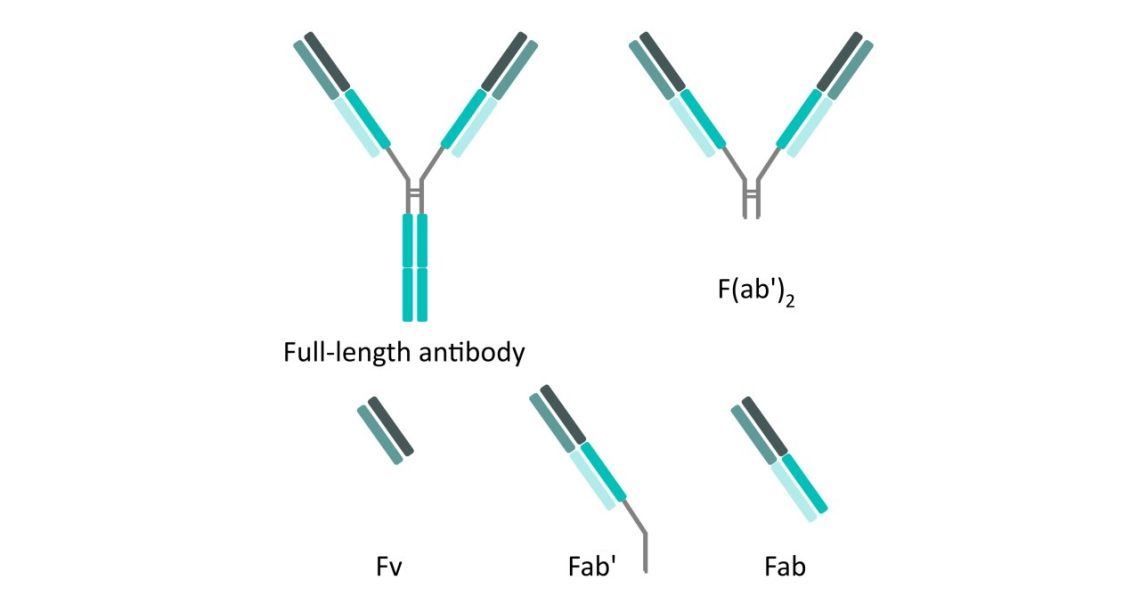
Abbildung 1. Fab-Fragment-Antikörper: Struktur von Antikörpern in voller Länge, F(ab')2, Fv, Fab' und Fab-Fragmenten
Featured Fab Antikörper
F(ab')2 Fragment Sekundärantikörper
F(ab')2-Fragment-Sekundärantikörper bieten eine wirksame Lösung zur Minimierung unspezifischer Bindungsinteraktionen zwischen den Fc-Anteilen von Antikörpern und Fc-Rezeptoren auf Zellen. Diese Antikörper werden durch einen Pepsinverdau erzeugt, bei dem der größte Teil der Fc-Region selektiv entfernt wird, während die Scharnierregion erhalten bleibt. Infolgedessen behalten die F(ab')2-Fragmente zwei antigenbindende F(ab)-Anteile, die durch Disulfidbindungen miteinander verbunden sind, wodurch sie ein Molekulargewicht von etwa 110 kDa erreichen.
Entdecken Sie unsere F(ab')2 Fragment Antikörper
Der Hauptvorteil der Verwendung von F(ab')2-Fragment-Antikörpern ist ihre Fähigkeit, unerwünschte Bindungen an Fc-Rezeptoren zu eliminieren. Dies ist besonders wichtig bei der Arbeit mit Geweben oder Zellen, die Fc-Rezeptoren exprimieren, wie Milz, Blutzellen, hämatopoetische Zellen und Leukozyten. Durch die Verwendung von F(ab')2-Fragmenten werden unspezifische Wechselwirkungen zwischen der Fc-Region des Antikörpers und den Fc-Rezeptoren auf diesen Zellen deutlich reduziert oder ganz eliminiert.
F(ab')2-Fragment-Antikörper werden häufig in verschiedenen experimentellen Techniken eingesetzt, darunter Durchflusszytometrie, Immunhistochemie und Immunfluoreszenz. Ihre Verwendung als konjugierte sekundäre Antikörper ermöglicht den spezifischen und zuverlässigen Nachweis von Zielantigenen in diesen Assays. Die mit F(ab')2-Fragmenten konjugierten sekundären Antikörper können bequem mit primären Antikörpern gepaart werden, die in verschiedenen Spezies gezüchtet wurden, und erleichtern so den Nachweis und die Visualisierung spezifischer Antigene in komplexen biologischen Proben.
Die Durchflusszytometrie, eine leistungsstarke Technik zur Analyse und Sortierung von Zellen anhand ihrer Oberflächenmarker, profitiert von der Verwendung F(ab')2-fragmentkonjugierter sekundärer Antikörper. Durch die Wahl eines F(ab')2-Fragments können Forscher die unspezifische Bindung an Fc-Rezeptoren minimieren, was zu einer verbesserten Spezifität und Genauigkeit bei der Identifizierung und Charakterisierung von Zellpopulationen führt.
In der Immunhistochemie, bei der es um die Lokalisierung und Visualisierung von Antigenen in Gewebeschnitten geht, spielen mit F(ab')2-Fragmenten konjugierte Sekundärantikörper eine entscheidende Rolle. Ihre reduzierte Interaktion mit Fc-Rezeptoren minimiert die Hintergrundfärbung und verbessert das Signal-Rausch-Verhältnis, was zu klareren und zuverlässigeren Färbemustern führt.
Auch in der Immunfluoreszenz, bei der fluoreszierende Marker verwendet werden, um die Verteilung und Ko-Lokalisierung von Proteinen in Zellen oder Geweben sichtbar zu machen, bieten mit F(ab')2-Fragmenten konjugierte sekundäre Antikörper eine höhere Spezifität und Empfindlichkeit. Durch die Verwendung von F(ab')2-Fragmenten können Forscher eine unerwünschte Bindung an Fc-Rezeptoren vermeiden, was zu einer verbesserten Genauigkeit beim Nachweis der Zielantigene und einer Verringerung der Hintergrundfluoreszenz führt.
Sekundäre F(ab')2-Fragment-Antikörper sind ein wertvolles Instrument für Forscher, die unspezifische Bindungsinteraktionen minimieren und die Spezifität ihrer Experimente verbessern wollen. Mit ihren intakten Antigenbindungsregionen und reduzierten Fc-vermittelten Effekten eignen sich F(ab')2-Fragment-Antikörper besonders für Anwendungen, die Gewebe oder Zellen mit Fc-Rezeptoren betreffen. Ihr Einsatz in der Durchflusszytometrie, der Immunhistochemie und in Immunfluoreszenztests ermöglicht einen präzisen und zuverlässigen Nachweis von Zielantigenen und verbessert die Qualität und Genauigkeit der Versuchsergebnisse.




